Pengertian Ligan
Ligan adalah sebuah ion atau molekul netral yang mampu mengikat secara
koordinasi atom atau ion logam pusat dalam senyawa kompleks. Ligan berperan
sebagai basa Lewis (donor pasangan elektron), dan logam pusat yang mengikatnya
berperan sebagai asam Lewis (akseptor pasangan elektron). Ligan mempunyai
paling tidak satu atom donor dengan sepasang elektron yang digunakan untuk
membentuk ikatan kovalen dengan atom atau ion logam pusat.
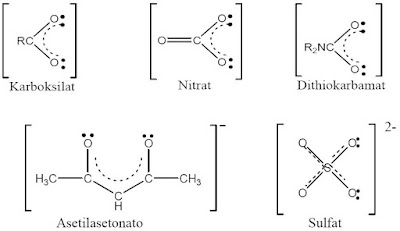 |
| Macam-macam Ligan |
Jenis-jenis Ligan
Ligan Monodentat
Ligan monodentat hanya mempunyai satu atom donor yang digunakan untuk
mengikat ion atau atom pusat. Contoh ligan monodentat adalah ion klorida
(disebut klorido), air (disebut aqua), ion hidroksida (disebut hidroksido), dan
amonia (disebut amina).
Ligan Bidentat
Ligan bidentat mempunyai dua atom donor dan keduanya dapat digunakan untuk
mengikat ion atau atom pusat. Contoh ligan bidentat adalah etilendiamin
(disingkat en) dan ion oksalat (disingkat ox). Gambar
di bawah merupakan etilen diamin, dimana warna biru merupakan atom nitrogen.
Masing-masing atom nitrohen mempunyai satu pasang elektron bebas yang dapat
digunakan untuk mengikat ion pusat.
Ligan Polidentat
Ligan polidentat mempunyai lebih dari dua atom donor yang digunakan untuk
mengikat logam atau ion pusat. EDTA yang merupakan ligan heksadentat adalah
contoh ligan polidentat. EDTA mempunyai enam atom donor yang mempunyai pasangan
elektron yang dapat digunakan untuk mengikat logam atau ion pusat.
Khelasi
Khelasi merupakan proses dimana ligan polidentat mengikat ion logam
membentuk suatu cincin. Kompleks yang dihasilkan melelui proses ini disebut
khelat, dan ligan polidentat disebut sebagai agen khelasi. Contoh ligan yang
mampu membuat khelasi adalah EDTA. Di bawah ini merupakan contoh kompleks
logam-EDTA.
Warna dan Sifat Magnet
Perubahan warna pada larutan disebabkan oleh penggantian ligan yang
mengikat atom pusat. Walaupu demikian, bilangan oksidasi ion pusat tetaplah
sama.
Deret Spektrokimia
Deret spektrokimia (spectrochemical series) merupakan susunan urutan
ligan berdasarkan besar atau kecilnya energi pembelahan orbital d pada
senyawa kompleks. Umumnya deret spektrokimia disusun dari kiri ke kanan, dimana
ligan pada sisi kiri mempunyai pembelahan yang paling kecil (medan ligan kuat)
dan ligan pada sisi kanan mempunyai pembelahan yang paling besar (medan ligan
lemah). Deret spektrokimia ligan adalah:
I- < Br- < S2- < SCN- <
Cl- < NO3- < F- < OH- <
C2O42- < H2O < NCS- <
CH3CN < NH3 < en < bipy < phen < NO2- <
PPh3 < CN- < CO
